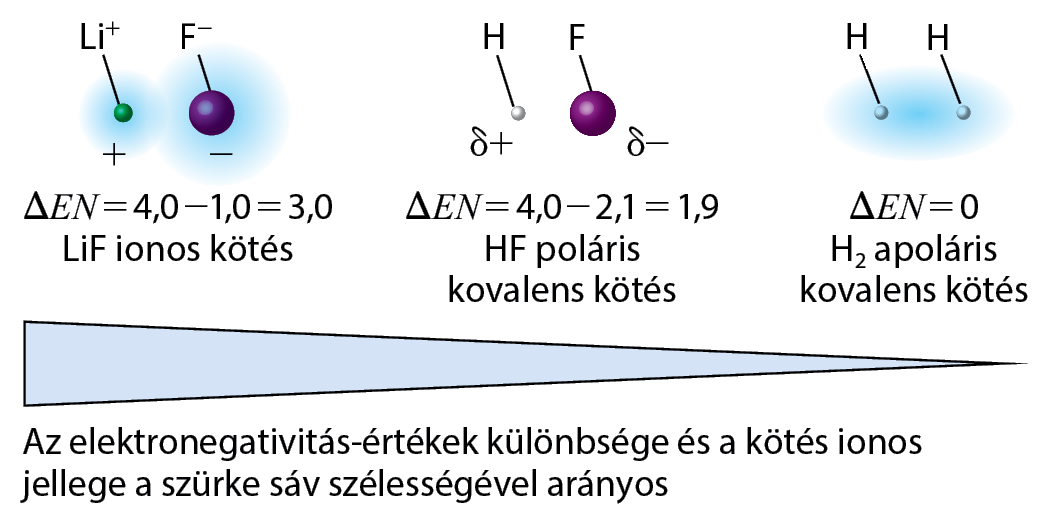
Az atomok közötti kötések alapvető szerepet játszanak a kémiai reakciókban és az anyagok tulajdonságainak meghatározásában. Két alapvető kötéstípus, a kovalens kötés és az ionos kötés, gyakran előfordulnak különböző vegyületekben, és alapvető különbségekkel rendelkeznek a működésükben és hatásaikban. Ebben a cikkben részletesen bemutatjuk a két kötés közötti különbségeket, azok jellemzőit, alkalmazásaikat és a különféle anyagokban betöltött szerepüket.
Mi a kovalens kötés?
A kovalens kötés olyan kémiai kötés, amely két atom között osztozó elektronok révén jön létre. Ez a kötéstípus akkor alakul ki, amikor két atom elektronjai kölcsönösen vonzzák egymást, és egy közös elektronpárt alakítanak ki. A kovalens kötés általában két nemfémes elem között jön létre. Az atomok közötti elektronok megosztása lehetővé teszi a stabilabb vegyület kialakulását. Ezt a típust elsősorban olyan anyagokban találjuk, amelyek molekulákban vannak jelen, mint például a víz (H2O) vagy a szén-dioxid (CO2).
Mi az ionos kötés?
Az ionos kötés egy másik típusú kémiai kötés, amely során az atomok elektronokat adnak át egymásnak, így a két atom ellentétes töltésű ionokká alakul. Az ionos kötés tipikusan egy fémes és egy nemfémes elem között jön létre, például nátrium (Na) és klór (Cl) között. A nátriumatom elektronját leadja, és pozitív töltésű ionná válik, míg a klóratom elektronokat vesz fel, és negatív töltésű ionná válik. A pozitív és negatív töltésű ionok között elektromos vonzás alakul ki, amely erős ionos kötést eredményez. Ionos vegyületek például a konyhasó (NaCl) vagy a magnézium-oxid (MgO).
A kovalens és ionos kötés közötti alapvető különbségek
Most, hogy megértettük a két kötéstípus működését, nézzük meg részletesebben a kovalens és ionos kötés közötti fő különbségeket:
1. Elektronok elosztása
A kovalens kötés esetében az atomok közötti elektronok megosztása történik, míg az ionos kötés során az elektronok átadása zajlik. A kovalens kötés tehát egy közös elektronpárt hoz létre, míg az ionos kötés esetén az egyik atom elektronokat veszít, a másik pedig elektronokat nyer.
2. Töltés
A kovalens kötésben a két atom között nincs jelentős töltéskülönbség, mivel az atomok elektronjaikat megosztják. Az ionos kötésben viszont az atomok ellentétes töltésű ionokká alakulnak, és az ellentétes töltésű ionok között erős elektromos vonzás alakul ki.
3. Atomok közötti vonzás
A kovalens kötésben az atomok közötti vonzás gyengébb lehet, mivel az elektronok csak részben vonzzák őket. Az ionos kötésben azonban az ellentétes töltésű ionok között erősebb vonzás alakul ki, amely stabilabb kötést eredményez.
4. Kötéstípusok és anyagok
A kovalens kötés jellemzően nemfémes elemek között alakul ki, míg az ionos kötés fémek és nemfémek között. Kovalens kötés például a szén-dioxid (CO2) vagy a nitrogén (N2), míg ionos kötésre példák az asztali só (NaCl) vagy a kalcium-fluorid (CaF2).
5. Olvadáspont és forráspont
Az ionos vegyületek magas olvadásponttal rendelkeznek, mivel az ionos kötések rendkívül erősek. Ezzel szemben a kovalens kötésben lévő vegyületek, különösen a gázok, alacsonyabb olvadáspontúak, mivel a kötések nem olyan erősek, és könnyebben elválhatnak egymástól.
6. Vezetőképesség
Az ionos vegyületek, mint a konyhasó, vezetőképesek, amikor oldódnak vízben, mivel az ionok szabadon mozoghatnak. A kovalens vegyületek, például a víz, nem vezetnek áramot, mivel nincsenek szabad ionok vagy elektronok a rendszerben.
Alkalmazások és szerepük az életben
A kovalens és ionos kötés különböző típusú anyagokban jelenik meg, és mindkettő fontos szerepet játszik az anyagok tulajdonságainak meghatározásában. A kovalens kötés jellemzően olyan anyagokban fordul elő, amelyek molekulákat alkotnak, mint például a víz, a szén-dioxid vagy az oxigén. Az ionos kötés viszont jellemzően szilárd anyagokban található, mint a sók, és elengedhetetlenek az elektromos vezetőképességhez is, amely az ipari alkalmazásokban is kulcsszerepet játszik.
Összegzés
A kovalens és az ionos kötés két alapvető kémiai kötési típus, amelyek különböző mechanizmusokkal és jellemzőkkel rendelkeznek. Míg a kovalens kötésben az elektronok megosztása, addig az ionos kötésben azok átadása történik. E két kötéstípus megértése kulcsfontosságú a kémiai reakciók és anyagok tulajdonságainak megértésében. Az egyik kötéstípus sem jobb a másiknál, mivel mindkettő más környezetekben és alkalmazásokban játszik szerepet. Ismerve ezeknek a kötéseknek a működését, jobban megérthetjük az anyagok viselkedését és azok alkalmazásait az iparban, a biológiában és a mindennapi életben.

